网站维护
系统内容更新/升级中

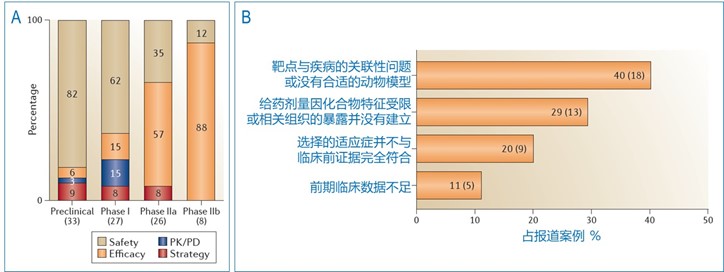
在一篇资深的新药研发综述 (Cook et al., 2014) 中,作者总结了临床实验失败的原因,发现在临床前及一期临床中,药物的安全性是导致失败的主要原因,但在二期临床中,药效则是主要原因,分别占IIa及IIb临床失败案例的57%及88% (图1A)。进一步分析显示,临床缺乏药效的案例中40%是由于靶点与疾病的关联问题或没有合适的动物模型造成的 (图1B)。由此可见,创新药物扎实的临床前生物学、药理学是临床成功的重要因素。
但是在me-too/fast follow策略的影响下,临床前药理药效研究有时会被误入盲区。这种me-too药理学的思路大致如下,如果适应症A的新药A申报成功,其药理药效使用的动物模型A是适应症A的合适模型。这个结论很快又被me-too新药A1的 (申报) 成功“证实”,于是模型A就会被应用到同样适应症的新药B的研发中。这个逻辑至少有两个盲区:第一,新药B与新药A的作用机制是否一致,模型A是否在机制上适用?第二,新药A在临床试验是否成功达到终点,模型A是否具备临床相关性?疾病动物模型是否临床验证过(clinically validated)可能是新药研发中一个重大的问题。
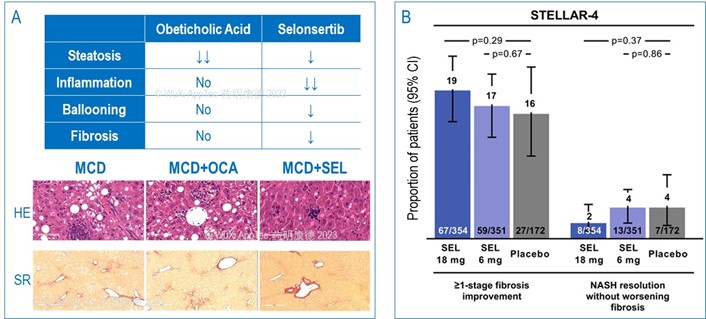
NASH新药研发中动物模型的选择一直备受关注,各类模型争议不断。奥贝胆酸Obeticholic Acid (OCA)及 Selonsertib (SEL) 是两款完成临床试验的NASH新药,在MCD小鼠动物模型中,前者除了对肝脂肪变性有效,对其它NASH病理指标都无改善,但SEL则对所有相关的病理指标都有改善作用 (图2A)。不过在临床试验中,OCA达到了终点 (数据未显示),SEL对纤维化指标及脂肪肝病理指标NAS的改善却没有统计意义 (图2B, Harrison et al., 2020)。这些结果对MCD模型的临床相关性提出了质疑。
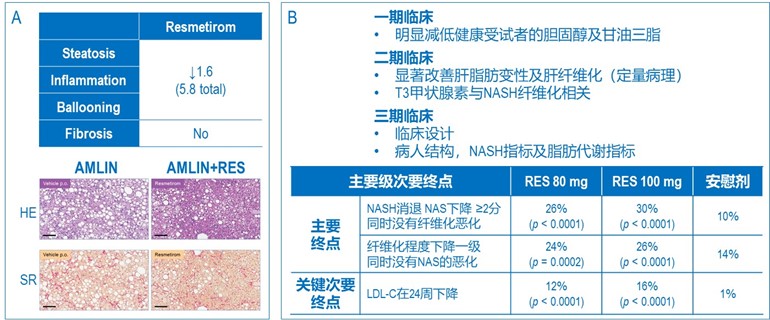
Resmetirom (RES) 是FDA今年年初批准的一款新机制NASH药,但在临床前药理测试中,AMLIN-DIO模型并没有充分地展示其药效及优越性,RES在该模型中仅微弱地改善了脂肪肝的病理指标,对纤维化基本无效 (图3A, Kannt et al., 2020)。不过RES在三期临床中表现出色,其成功是依赖于一期及二期临床的终点设计,一期临床显示了RES在健康受试者中明显降低血液胆固醇及甘油三脂,二期不仅显示了该药对NASH相关的纤维化有明显改善,而且建立了药物靶点/作用机制与病理的临床关联性,以及药物仅在肝脏起作用 (排除了类似药物在其它器官的临床毒性)。三期临床的设计则充分利用了前期的数据,针对RES的特点,优化了临床设计,同时达到了两个主要终点及一个关键次要终点 (图3B)。
上述两个实例通过追踪药物的临床试验,我们可以对MCD及AMLIN-DIO模型的NASH临床相关性做出初步判断。
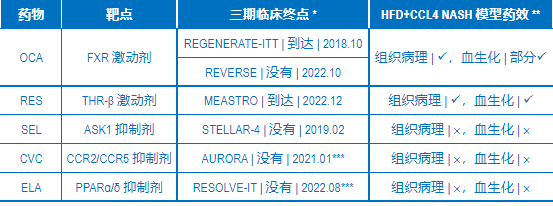
问题是,有没有这类动物模型,它的临床前药效研究结果与NASH新药的临床结果一致/基本一致?药明康德研发生物部NASH体内药理团队对多个模型进行了病理比较,测试了相关药物在这些模型中的药效,发现HFD+CCL4模型的药效结果与药物的临床结果保存高度的一致性。如图4所示,OCA及RES能显著改善HFD+CCL4模型中脂肪肝指标NAS,并同时下降肝纤维化,与此相反,另外三个药物SEL,CVC (cenicriviroc) 及 ELA (elafibranor) 则没能改善该模型的相关NASH病理指标 (除了ELA降低模型中的肝纤维化)。
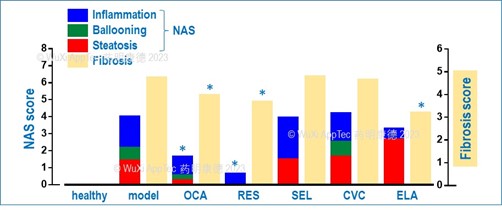
上述后三个化合物 (SEL, CVC及 ELA) 在各自的临床试验中或没有达到终点或提前终止 (表1),它们在HFD+CCL4模型中的药效表现与临床结果一致。RES在三期临床上达到的所有终点,在该模型中改善了肝脂肪NAS及纤维化指标 (图4A),同时也改善了相应的血生化指标 (数据未显示)。OCA在治疗NASH患者的RENERATE-ITT三期临床试验中达到临床终点,但在另一个治疗肝硬化的REVERSE三期临床并没有达到终点,在作为NASH的HFD+CCL4模型中改善了相关的病理指标,同时也改善了部分的血生化指标 (数据未显示)。我们在这个模型中还测试了其它在临床试验中的药物,它们的结果与迄今的临床结果高度一致 (数据未显示),进一步验证了该模型的临床相关性。
实际上,动物模型的临床相关性是模型效度(validity) 的延伸,是后者的属性。那效度又是如何来衡量的?这个可以从三维度来考虑,第一,病因及机制(etiology);第二,病理及症状( symptoms);第三,治疗及结果( therapy),也就是说,模型的病理及症状是由什么病因及机制造成的?这些病理和症状又是如何对药物的治疗作出反应的?可以看出,动物模型的构建是决定效度的关键。
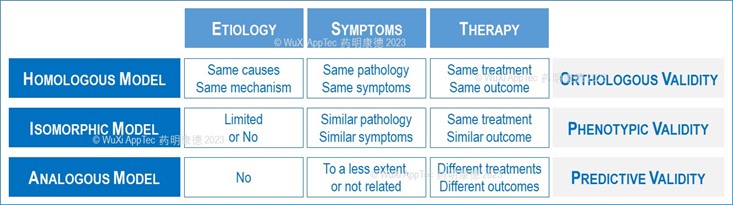
根据建模机制,动物模型可以大致分成三类 (图5):
第一,同源( homologous) 模型。导致这类模型病理及症状的病因或机制与人类疾病本身基本是一致的,病理、症状也跟临床有很大的一致或重叠,原理上治疗疾病的药物在这类模型中可以达到一致或非常类似的药效。这类模型的直系同源性效度 orthologous validity是可以通过现有的临床药物直接验证,它们的临床相关性一般都比较高;
第二,同型(isomorphic) 模型。有些疾病的病源无法在动物中再现,另外一些的病源可能尚不清楚,但疾病的病理和症状则是相对明确的,这类疾病的动物模型构建往往依赖病理和症状,而构建的手段和机制与病源可能仅有一部分相似性,这类模型的效度仅限于表型 (phenotypic validity),尽管模型的病理指标有时与临床指标有不少一致性或重叠,它们的临床相关性必须谨慎分析、充分验证。上述的HFD+CCL4小鼠NASH模型就属于同型模型,造模中使用的高脂饲料HFD诱导与脂肪肝的病源有很大程度的相似性,而直接导致纤维化的是CCL4,但是这个模型的临床相关是基于HFD与CCL4组合诱导的额外纤维化,这部分肝纤维化是临床成功药物奥贝胆酸及RES等的药效靶点 (数据未显示);
第三,类似(analogous)模型。有些疾病的症状并不能如实在动物中体现,它们的病理基础有较大的不确定性,在动物模型或测试中,往往只能依靠替代指标建模,但是,这类模型的有用之处在于它们可以区分不同机制药物的药效,所以具备预测(predictive) 效度。上述分类动物模型的方法并不是一成不变,有些模型可能介于两者之间,当然也不是所有模型都可以按这三种来分类。
从原理上来说,细菌、真菌、病毒感染模型应该是同源模型,但由于物种的差异,感染模型的病理也会出现不同,总的来说,这类模型在临床前药理结果与临床试验有较大程度的相关性。此外还有哪些同源动物模型?造成慢性阻塞性肺病 (Chronic Obstructive Pulmonary Disease, COPD) 的直接原因是长期吸烟,能不能用同样的方法在动物中建COPD模型?
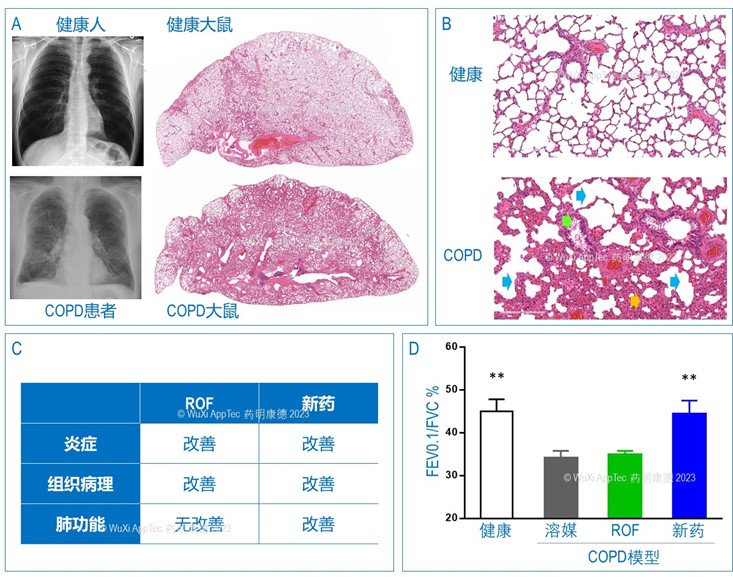
如图6A所示,大鼠经过4-6个月的“吸烟”,肺的组织病理发生巨大变化,出现了支气管阻塞、肺气肿等肺组织病变特征及炎症反应 (图6B),与人类的COPD病理有高度的相似性。临床上用于治疗COPD的罗氟司特 roflumilast (ROF) 抑制肺部的炎症反应,进而抑制COPD对肺组织造成的损伤,但是并不能有效逆转肺功能的损伤。在这个动物模型中,ROF的药效主要集中在炎症反应及组织病理的改善,对肺功能没有明显改善 (图6C)。我们在同一个模型中测试了一款新机制的药物,除了改善炎症反应及组织病理指标,这款药物能明显地改善肺功能 (图6D)。
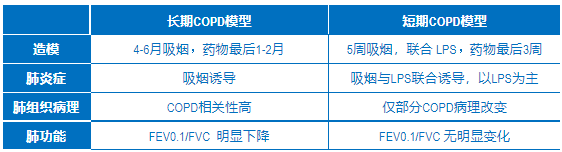
除了长期吸烟COPD模型,还有一个相对短期的模型 (表2),造模时间为5周,动物经过5周“吸烟”的同时联合LPS,以模拟临床COPD急性加重期的肺部炎症变化特征。与前者相比,短期模型各项炎症及病理指标虽然与COPD类似,但炎症反应主要以LPS诱导为主,病理特征仅部分与COPD相关。更重要的,这个模型并不能诱导肺功能的损伤—— COPD临床诊断的金标准是不完全可逆性气流受限,第1秒用力呼气量占用力肺活量低于70% (FEV1.0/FVC < 70%)。而在长期吸烟COPD模型中,肺功能出现类似变化,即第0.1秒的呼气量占用力肺活量 (FEV0.1/FVC) 明显低于对照组,新药能明显改善这项功能指标,但ROF并不能。新药的药理优势在这个动物模型中得到了充分的体现 (图6C, 6D)。
药明康德研发生物部体内药理团队已经建立了一个相对完整的以疾病为中心的药理药效平台,表3覆盖的大多数疾病动物模型都是按文献报道的方法来建立的,负责这些模型的是在相关疾病领域积累丰富实践经验的药理研究人员,涉及动物包括小鼠、大鼠、兔、狗、猪及非人灵长类等。在这个基础上,我们选择了一部分重大疾病的模型,发展转化药理学,其目的是研究临床相关性,拓展模型在疾病机制研究上的应用。我们的发展策略着重三个方面:第一,基于疾病机制,建立新颖动物模型;第二,在现有的动物模型中研究疾病机制;第三,在大动物里发现自发疾病。以下用三个案例展示药明康德体内药理团队如何落实转化药理的发展策略。

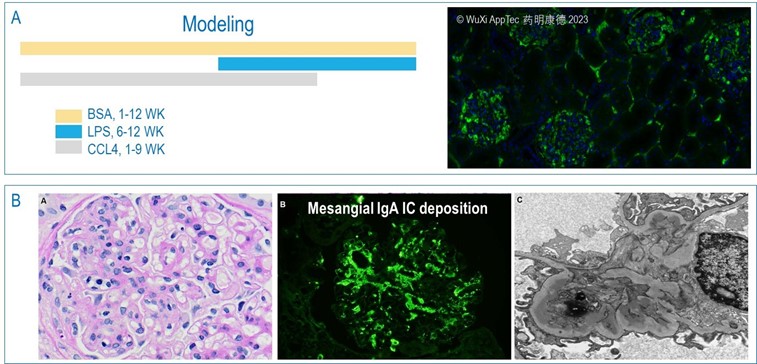
IgA肾病 (IgA nephropathy, IgAN) 的动物模型文献已有报道,我们按此建立了BSA/LPS/CCL4诱导模型,发现多个病理指标并不稳定,该疾病重要的组织病理学特征,IgA在肾小球系膜上的积累 (mesangial IgA deposition),并没有在这个模型中体现出来 (图7A),其它的病理指标,包括IgA的升高,炎症反应及肾损伤是由BSA,LPS及CCL4分别诱导的。我们认为该模型并不能充分显示IgAN。
进一步研究发现,IgAN并不是nephrotic 而是 nephritic,两者的区分在于,前者是基于肾小球损伤而导致的高尿蛋白症及高血蛋白、血脂、血胆固醇症,后者是由肾小球炎 glomerulonephritis (局部细胞增生及炎症化 focal proliferation and inflammation)及 IgA 免疫复合体 (immune complex) 在肾小球系膜上的积累而导致的高血尿症hyper-hematuria及高血氮症 azotemia (Penfold et al. 2018)。图7B对IgAN 的肾组织病理做了总结。根据对IgAN 疾病的了解,我们正在建造基于病理的模型。
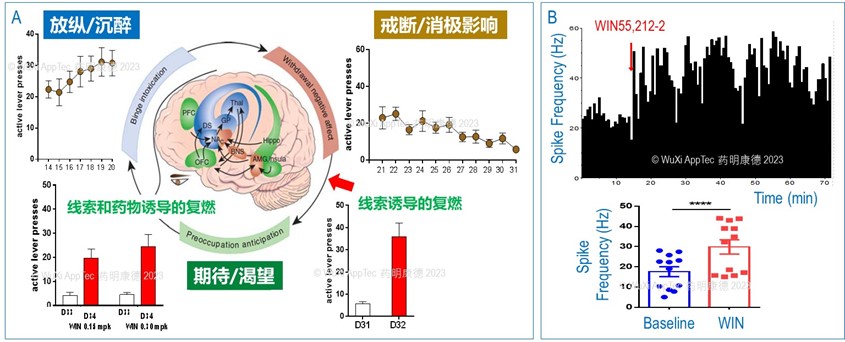
自我给药成瘾大鼠模型是基于人类成瘾三个阶段而建立的 (图8A),在第一个放纵阶段,动物学会通过按压有效杆(active lever)获得成瘾药品 (WIN55,212-2, CB1 receptor agonist),在每次按压有效杆时,线索灯都会亮,随着时间动物按压有效杆的次数逐渐上升。在第二个戒断阶段,按压有效杆不再获得成瘾药品,同时线索灯也不再亮,随着时间动物按压有效杆的次数逐渐下降。在接下来的复燃中,动物会在线索灯亮时选择性地按压有效杆,但并不能获得成瘾药品,即使如此,动物对线索灯的反应与选择性按压有效杆有密切关联。此后,如果线索灯不亮,选择性按压有效杆也会消失。但是,如果动物先注射给了成瘾药物,线索灯亮时,动物又会选择性地按压有效杆,即使在这个阶段按压有效杆并不能获得成瘾药品。这个模型成功地模拟了成瘾、戒断、复燃的三个戒断 (图8A)。
除成瘾及奖赏相关行为外, 抑郁、焦虑与恐惧、精神分裂症等神经精神疾病的动物模型大部分是通过行为诱导,来改变行为一般以行为学表征为坚实基础。那么,相应的行为学表征是否有相应的神经生物学变化?针对这类问题,我们对成瘾大鼠的中脑腹侧被盖区 (Ventral tegmental area VTA, 重要的多巴胺能神经元投射脑区,普遍认为与成瘾有关) 的电生理特征做了进一步研究。在自我给药成瘾模型中,当大鼠形成药物依赖并戒断后,我们给动物注射了再次接受了成瘾药物的注射。同时,我们通过单个单元记录(single unit recording)记录了VTA区域的神经元放电频率 (图8A 中红色箭头)。与同一区域基线 (同一动物在给药前) 相比,药物诱导的放电频率出现明显提高 (图8B),与不建模的对照动物相比,这个放电频率的提高也是显著的 (数据没有显示)。我们的实验结果验证了大鼠VTA 在造模后出现了特异的电生理病变,展示了该模型的临床相关性。
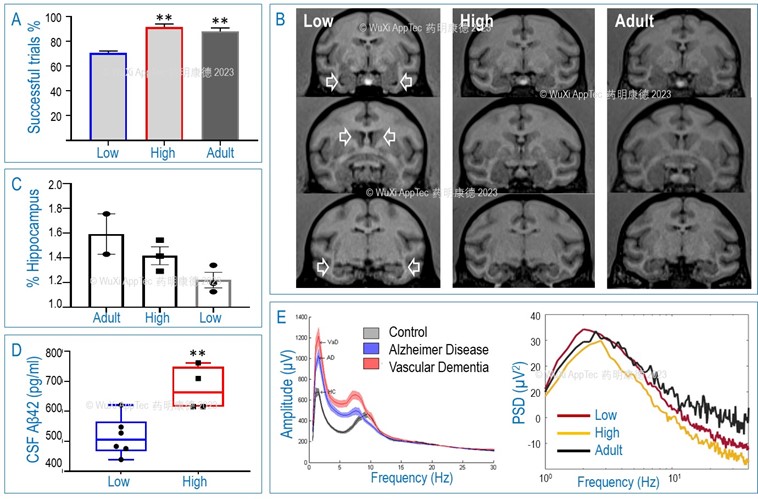
在一个研究NHP自发性神经退行性疾病项目中,我们选择了10个老年 (20-25岁) 大动物和4个成年 (10-15岁) 大动物,对它们做了短期记忆测试( short-term memory test ,STMT),根据10秒记忆成功率将它们分为三组,成年组 (A组,4个, STMT成功率>80%),老年高组 (H组,4个,成功率>80%),老年低组 (L组,6个,成功率<80%) (图9A,L组与其它两组都有统计学意义)。为了进一步探索这些动物的认知行为缺陷与阿尔兹海默症的相关性,我们利用临床上常用的阿尔兹海默症诊断工具如功能影像,脑电图及脑脊液蛋白含量等对这些动物进行了扫描分析。MRI活体大脑成像显示L组的脑室相对增大 (图9B),三组动物的归一化 (以整个大脑体积) 后的海马体积平均值有差异,H组小于A组,L组小于H组 (图9C)。我们又发现,L组动物脑脊液的Aβ42 的含量明显低于H组 (图9D)。同时,据文献报道,阿兹海默症患者EEG低频率δ (0.5-3 Hz) 和θ (4-7 Hz) 波的能量比正常人的要高,而β (14-30 Hz) 波能量则低于正常对照 (图9E,Neto et al., 2015)。我们的数据结果与此一致,也发现L组的δ波能量是三组动物中最高的,而该组的β (14-30 Hz) 波能量则低于A组 (但高于H组) (图9E)。合在一起,我们的数据揭示,L组动物的认知缺陷 (健忘) 很可能是与阿兹海默症相关的。
新药进入临床人体试验前的三个重要问题是:1. 人体会对药物做些什么?2. 药物会对人体做些什么?3. 药物会对疾病做些什么?要回答这三个问题 (药物在内靶点及其它器官/组织代谢及暴露量、对人的副作用及安全性、对疾病的治疗及病人的获益),动物实验是迄今无法逾越的实验手段。生物医学伦理专家 Kimmelman 教授在Nature上发表题为 ”Consider drug efficacy before first-in-human trials” 的评论,认为将极有可能无效无益的“药物”投入临床试验应该是医学伦理值得探讨的问题,并提出动物研究提供了最终“评估实验性治疗是否足以有希望而值得对人进行测试”的实验手段。
Animal studies provide the experimental means to ultimately “evaluate whether an experimental treatment is promising enough to warrant testing on people” (Kimmelman 2017).
参考文献:
[1] Cook et al., (2014) Nature Reviews Drug Discovery3:419-431. DOI: 10.1038/nrd4309.
[2] Harrison et al., (2020) Journal of Hepatology 73:26-39. DOI: https://doi.org/10.1016/j.jhep.2020.02.027.
[3] Kannt et al., (2021) British Journal of Pharmacology 178:2412-2423. DOI: 10.1111/bph.15427.
[4] Kimmelman, (2017) Nature 542:25–27. DOI: 10.1038/542025a
[5] Neto et al. (2015) Frontiers in Neurology 6:25. DOI: 10.3389/fneur.2015.00025
[6] Penfold et al., (2018)International Journal of Nephrology and Renovascular Disease 11:137-148. DOI: 10.2147/IJNRD.S129227